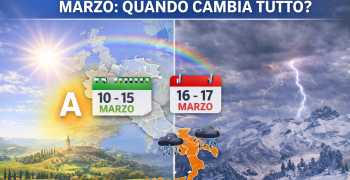
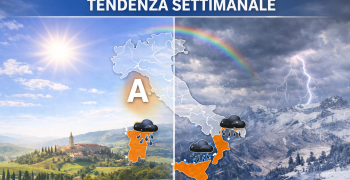
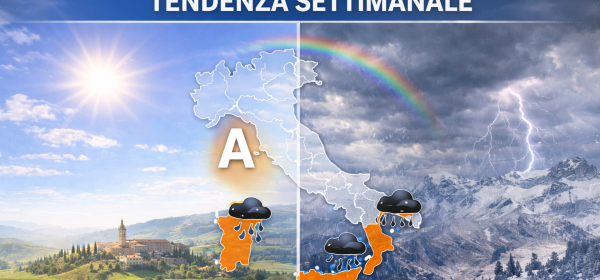
L'epidemia di influenza "A" sta
montando rapidamente, e si teme un ulteriore boom tra agosto e
settembre, tanto da indurre l'Europa ad accelerare la
produzione dei vaccini, soprattutto per i piu' piccoli. Ma
sulle pagine dell'autorevole quotidiano inglese "The
Independent" gli esperti mettono in guardia sui possibili
rischi nella somministrazione cosi' "frettolosa" di vaccini
che, per forza di cose, non saranno ancora stati testati a
sufficienza sull'uomo. In particolare, denunciano gli
scienziati, le prime dosi di vaccino contro l'influenza suina
saranno distribuite al pubblico ad agosto prima che siano
disponibili dati completi sulla sua sicurezza ed efficacia.
Inoltre, a differenza del vaccino contro l'influenza
stagionale, quello per il nuovo virus sara' somministrato in
due dosi, in quantita' piu' massicce dunque, e dovrebbe
contenere prodotti chimici additivi che aumenteranno il rischio
di effetti collaterali. Su questi temi sono in corso frenetiche
sperimentazioni, ma e' probabile che i bambini, piu'
vulnerabili alla influenza suina e quindi presumibilmente i
primi a venire vaccinati, saranno trattati almeno un mese prima
che i risultati dei test siano pronti e analizzati. Secondo
Adam Finn, professore di pediatria presso l'Universita' di
Bristol e esperto in materia di vaccinazione, "ci sara' un
periodo in cui si dovra' valutare attentamente il rischio, e il
rapporto costi-benefici, specie se ci sara' un ulteriore
aumento dei casi e dei decessi. Di certo si deve agire il piu'
presto possibile". Sicuramente l'Emea accelerera' i processi di
autorizzazione all'utilizzo dei vaccini, anche dietro la
pressione dell'opinione pubblica, ma i medici invitano alla
prudenza: un precedente di vaccino contro l'influenza suina si
e' infatti rivelato peggiore del male. Nel 1976 oltre 40
milioni di persone erano state vaccinate in America contro una
precedente "versione" del virus, col risultato di 25 morti e
500 ammalati di una rara infiammazione del sistema nervoso, la
sindrome di Guillain-Barre, ritenuto un effetto collaterale del
farmaco e che ha portato alla paralisi e alla morte diverse
persone. Anche per questo il dibattito e' aperto tra i
produttori, l'Emea e i ministeri della Salute europei su quanti
e quali dati scientifici saranno indispensabili prima di dare
il via libera a un vaccino. Secondo un portavoce dell'Emea i
primi campioni del vaccino pandemico completamente funzionali
sono attesi per la fine di luglio e una decisione in merito
alla loro approvazione sara' presa entro un termine di cinque
giorni. Sono stati svolti test su un gruppo di 200-400
pazienti, ma il vaccino potrebbe essere distribuito prima di
conoscere l'esito dei test. "I primi vaccini non avranno il
conforto di una sperimentazione clinica completa - ha
confermato il portavoce dell'Emea - mentre ci aspettiamo i dati
intermedi sugli adulti a partire da settembre e i dati
pediatrici da ottobre in poi".